El átomo, la unidad base del estudio de la materia. Es aquí donde inicia la aventura de los elementos, la materia prima, las reacciones químicas y el Universo.
En la antigua Grecia, gracias a Leucipo y su alumno Demócrito, se acuñó el termino atŏmus que significaba "que no se puede cortar, indivisible", porque se refería a una cosa que no podía dividirse (cortarse) más. Por lo que era la expresión mínima de la materia. A través de los años, este concepto ha ido cambiando y ahora sabemos que los átomos están formados por tres partículas: protones, neutrones y electrones, que están compuestos por partículas aún más pequeñas, como los quarks.
De acuerdo a la comunidad científica, se define que:
"El átomo es la unidad más pequeña de la materia que aún tiene las propiedades características de un elemento químico. Consiste en un núcleo de carga positiva que tiene más del 99.9% toda su masa y una nube de electrones que determinan su tamaño".
Además, el átomo es la unidad más pequeña en la que se puede dividir la materia sin la liberación de partículas cargadas eléctricamente.
Ahora que sabemos qué es el átomo, vayamos más a fondo. Conozcámoslo.
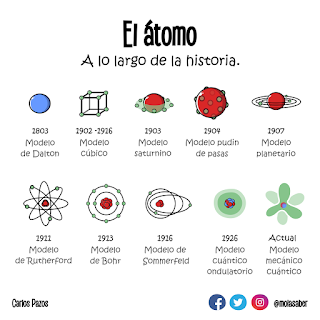
Modelo Atómico
A lo largo de la historia, han habido diferentes modelos atómicos. Estos han variado de definiciones, cada uno buscando explicar y comprender la materia para así poder clasificarla, pero muchos han sido descartados. Muchos de estos modelos no podían abarcar todos los comportamientos de la materia.
Modelo Leucipo y Demócrito
Concedieron la idea de que el átomo era el resultado de cortar la materia las suficientes veces hasta llegar a partículas que no se pueden dividir más. Entonces, si juntabas átomos estas partículas ibas a obtener la materia inicial. Por ejemplo, los trozos de una piedra partida en dos, incluso reducida a polvo, siguen siendo piedra, y cada uno de los fragmentos resultantes puede volver a dividirse.
La materia no puede dividirse indefinidamente, por lo que debe existir una unidad o bloque indivisible e indestructible que al combinarse de diferentes formas, creara todos los cuerpos macroscópicos que nos rodean.
Mencionaron además que los átomos se consideraban eternos e indestructibles, que todo lo que se observaba era resultado del movimiento de los átomos que difieren de sus formas, dimensiones y posiciones.
Esta doctrina, que defiende que la materia está formada por pequeñas partículas y que no es indefinidamente divisible, se llama atomismo. Esto condujo de manera gradual a las definiciones modernas que se tiene sobre los elementos y compuestos.
Esta doctrina, que defiende que la materia está formada por pequeñas partículas y que no es indefinidamente divisible, se llama atomismo. Esto condujo de manera gradual a las definiciones modernas que se tiene sobre los elementos y compuestos.
Teórica Atómica de Dalton
El trabajo de Dalton es el primer modelo con bases científicas, esto da la base de la Teoría Atómica Moderna. Su trabajo inicia en un laboratorio, donde se da cuenta que hay diferencias en las propiedades de los elementos como el hidrógeno y el oxígeno.
La teoría atómica basada en las leyes de las proporciones definidas y de las proporciones múltiples, reconoció su deuda con Demócrito manteniendo el termino Átomo para las pequeñas partículas que formaban la materia. A partir de esto, Dalton explica la idea de que los átomos de hidrógenos son diferentes de los átomos de oxígeno.
Aunque el trabajo de Dalton es más detallado, este no describe la estructura, la composición del átomo o la carga eléctrica.
Los postulados de Dalton, que sustentan su modelo, fueron:
- Los átomos del mismo elemento son idénticos en todos los aspectos, pero los átomos de un elemento son diferentes de los átomos de otros elementos.
- El átomo no se puede dividir.
- Los átomos de diferentes elementos se combinan en una simple proporción entera para formar compuestos.
Modelo de Thomson
Entre los estudiantes, conocido como El budín de pasas.
Modelo de Ernest Rutherford
Aquí aparecen por primera vez la idea de los protones.
Modelo de Niels Bohr
Aquí aparece los niveles de electrones. Aparecen los orbitales. Luego de varios descubrimientos, investigaciones y consensos, la comunidad científica afinaba cada vez más el concepto de átomo, que es lo que contenía y cuál era la estructura. Hasta que, en 1808, el científico Dalton se formula una definición precisa de las unidades indivisibles que conforman la materia,
Unidades subatómicas
El átomo está compuesto por tres subpartículas:
- Protones, con carga positiva.
- Neutrones, sin carga eléctrica (o carga neutra).
- Electrones, con carga negativa.
A su vez, se divide en dos partes:
- El núcleo. Formado por neutrones y protones.
- Nube de electrones. Formada únicamente por electrones.
Protón
Neutrón
Electrón
Propiedades Básicas
Número Atómico
Masa Atómica
Referencias:
- Asimov, I., Cruz, A. y Villena, M. I. (1975). Breve historia de la Química. Alianza
- Chang, R. y Overby, J. (2019). Chemistry. McGraw-Hill.
- Khan Academy Partners. (28 de abril de 2019). The history of atomic chemistry | Electronic structure of atoms | Chemistry | Khan Academy [Archivo de Video]. YouTube. https://youtu.be/agjG7kgixJs
- McNaught, A. D. (1997). Compendium of Chemical Terminology. Blackwell Science. https://doi.org/10.1351/goldbook.
Seguir leyendo:






No hay comentarios.:
Publicar un comentario